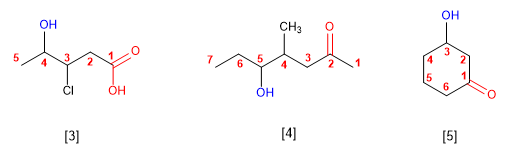
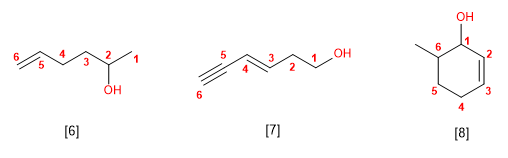
Existen diversas moléculas cuyos electrones no parecen estar localizados en posiciones fijas (estructuras de Lewis) sino dispuestos en diferentes posiciones. La teoría de la resonancia explica esto suponiendo que dichas moléculas son un compuesto intermedio entre una serie de estructuras moleculares llamadas formas resonantes. Cada una de ellas, por sí misma, no existe, existe el conjunto llamado híbrido de resonancia.
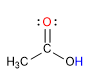
Por ejemplo, los electrones en el ion acetato (CH3CO2-) pueden considerarse como localizados en dos diferentes disposiciones:
El híbrido de resonancia posee una menor energía (y por tanto es más estable) que cada una de las formas resonantes.
Las distintas formas canónicas o resonantes deben tener el mismo número y la misma clase de núcleos de átomos y el mismo número de electrones. La diferencia entre unas formas canónicas y otras se encuentra exclusivamente en la posición de los electrones.
Para que exista resonancia deben existir al menos dos formas resonantes que tengan energía similar si no la molécula perfectamente representada por la de menor energía que sería la predominante.
Cuanto mayor sea el número de formas resonantes la molécula será más estable.
Toda molécula que sólo posea enlaces simples no tiene formas resonantes. Las moléculas con enlaces múltiples pueden tener formas resonantes o no.
La resonancia estabiliza las moléculas e iones, lo cual puede explicar diversas tendencias de las reacciones químicas. De dichas tendencias se induce lo siguiente:
- Si un reactivo (material de partida) está estabilizado por resonancia, las reacciones químicas de esta molécula estarán menos favorecidas que en ausencia de resonancia.
- Si un producto (material resultante) está estabilizado por resonancia, las reacciones de las que se obtiene estarán más favorecidas.
Acidos y bases.
Según la Teoría de Bronsted-Lowry:
ÁCIDO es todo compuesto capaz de ceder un protón.
BASE es todo compuesto capaz de aceptar un protón.
Según la Teoría de Lewis:
ÁCIDO es toda sustancia capaz de aceptar un par de electrones.
BASE es toda sustancia capaz de ceder un par de electrones.
Aunque la Teoría de Lewis parece diferente, es coherente con otras teorías. La teoría de Bronsted-Lowry se refiere al ion H+. La definición de Lewis se refiere a los pares de electrones (que conllevan una carga negativa). En la teoría de Bronsted-Lowry es el protón H (H+) el que se mueve. En la teoría de Lewis, los electrones forman enlaces, que "tiran" de los átomos para llevarlos a sus nuevos posiciones.
| Ácido | Base | |
| Bronsted-Lowry | Donante de H+ | Receptor de H+ |
| Lewis | Receptor de e- | Donante de e- |
El sistema alilo forma carbocationes, carbaniones y radicales muy estables debido a la estabilización de la carga por resonancia. Tanto la carga positiva, negativa como el radical se deslocalizan sobre dos átomos de carbono generando estructuras de resonancia energéticamente equivalentes, denominadas alilo. El carbono que soporta la carga se conoce como posición alílica.

Otros ejemplos de resonancia en sistemas alílicos son: